Cientistas têm usado doenças genéticas raras como uma espécie de “janela” para entender melhor problemas comuns de saúde. Um exemplo recente envolve a deficiência de citrina, alteração hereditária que afeta o metabolismo do fígado e ajuda a explicar por que algumas pessoas acumulam gordura no órgão, mesmo sendo magras, e ao mesmo tempo demonstram pouco interesse por açúcar e álcool. Em suma, as descobertas apontam para uma conexão direta entre funcionamento hepático, hormônios e preferências alimentares, o que amplia nossa compreensão sobre doenças metabólicas modernas.
Esse distúrbio metabólico é causado por uma alteração no gene SLC25A13, responsável por uma proteína que auxilia o fígado a transformar carboidratos em energia. Quando essa proteína não atua de forma adequada, o caminho normal dos nutrientes fica prejudicado. Portanto, o resultado é um fígado que precisa encontrar “atalhos” bioquímicos para lidar com açúcar e outras substâncias, produzindo efeitos que vão desde o acúmulo de gordura até mudanças no comportamento alimentar. Além disso, esses “atalhos” podem, a longo prazo, aumentar o risco de inflamação hepática e de progressão para quadros mais graves, como fibrose e, em alguns casos, cirrose.
Deficiência de citrina e metabolismo hepático
A deficiência de citrina faz com que o fígado tenha dificuldade em utilizar carboidratos de maneira eficiente. Dentro das células hepáticas, moléculas ligadas à produção de energia, como o NADH, não são transportadas corretamente para a mitocôndria, estrutura muitas vezes descrita como a “usina” celular. Então, essa falha compromete a forma como o órgão lida com açúcares, mesmo quando a ingestão diária não é considerada alta, e pode levar o organismo a depender mais de gordura e proteínas como fonte energética.
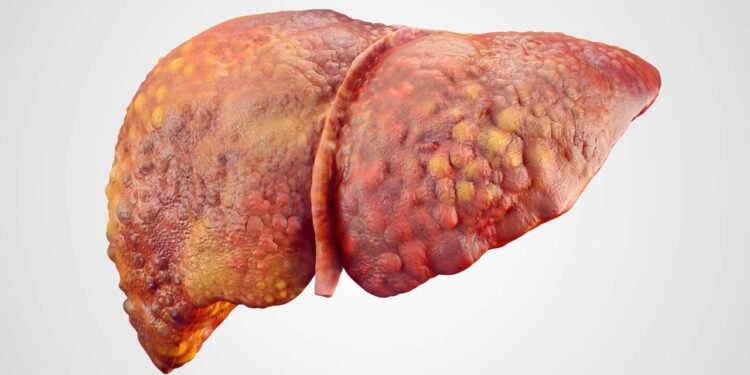
Curiosamente, indivíduos com essa condição costumam ser magros, mas podem desenvolver doença hepática gordurosa associada à disfunção metabólica, hoje conhecida pela sigla MASLD. A MASLD é caracterizada pelo acúmulo de gordura nas células do fígado, sem relação obrigatória com o consumo de álcool. Entretanto, no caso da deficiência de citrina, essa gordura se forma em um contexto de metabolismo desorganizado, não necessariamente de excesso calórico evidente. Em suma, a mensagem principal é que peso na balança, sozinho, não revela o verdadeiro estado metabólico do fígado.
Como a deficiência de citrina leva à gordura no fígado?
Pesquisas recentes indicam que, quando o gene SLC25A13 apresenta falhas, ocorre um acúmulo de glicerol-3-fosfato (G3P) dentro do fígado. Esse composto atua como um sinalizador que ativa uma proteína reguladora chamada ChREBP, responsável por controlar vários genes ligados ao uso de carboidratos. Em outras palavras, o aumento de G3P “liga” um interruptor que reorganiza o metabolismo hepático. Portanto, em vez de apenas queimar glicose de forma eficiente, o fígado passa a redirecionar esse combustível para vias que favorecem a formação de gordura.
Ao ser ativado, o ChREBP estimula simultaneamente dois processos: a produção de gordura no fígado e o aumento da síntese de um hormônio conhecido como FGF21. A lipogênese, ou formação de gordura, contribui para a esteatose hepática, enquanto o FGF21 é liberado na circulação e passa a atuar em órgãos como o cérebro, influenciando comportamento alimentar e equilíbrio energético. Então, enquanto o fígado acumula lipídios, o cérebro recebe sinais que reduzem a busca por açúcar e álcool, numa tentativa de defesa do organismo contra sobrecarga metabólica.
O FGF21 vem sendo estudado há alguns anos por seu papel como mensageiro entre fígado e sistema nervoso central. Níveis elevados desse hormônio já foram associados à redução do desejo por doces e bebidas alcoólicas, além de ajustes no gasto energético do corpo. Na deficiência de citrina, a elevação persistente do FGF21 ajuda a explicar a tendência desses pacientes a rejeitar açúcar e álcool de forma espontânea, funcionando como uma espécie de “freio hormonal” ao consumo desses produtos. Portanto, o que muitas vezes parece apenas uma “preferência alimentar” pode, na verdade, refletir uma adaptação biológica profunda.
Gordura no fígado: o que é e por que vai além da obesidade?
A chamada “gordura no fígado” corresponde à esteatose hepática, situação em que as células do órgão passam a acumular lipídios em quantidade acima do normal. Nos estágios iniciais, a condição costuma ser silenciosa e pode ser detectada apenas em exames de imagem ou laboratoriais de rotina. Com a progressão, podem surgir sinais como cansaço, desconforto abdominal e aumento do volume hepático. Entretanto, mesmo antes de sintomas claros, a esteatose já pode se associar a maior risco cardiovascular e resistência à insulina.
Em grande parte dos casos, a esteatose está ligada à obesidade, ao diabetes tipo 2, ao colesterol elevado e ao consumo excessivo de álcool. No entanto, estudos recentes mostram que pessoas magras, indivíduos que não bebem e até crianças também podem desenvolver doença hepática gordurosa. Fatores hormonais, sedentarismo, alimentação rica em açúcares simples e predisposição genética participam desse cenário. Portanto, avaliar o fígado tornou-se essencial mesmo em pessoas com peso “normal”, especialmente se elas apresentam cansaço, alterações em exames de sangue ou histórico familiar de doenças hepáticas.
- Principais fatores associados à gordura no fígado comum:
- Alimentação com excesso de frutose, bebidas adoçadas e ultraprocessados;
- Resistência à insulina e diabetes;
- Colesterol e triglicerídeos elevados;
- Sedentarismo e baixa massa muscular;
- Uso crônico de álcool em quantidades variadas, dependendo da sensibilidade individual.
O que essa descoberta pode significar para o futuro?
Embora a deficiência de citrina seja rara, o mecanismo G3P–ChREBP–FGF21 pode ajudar a entender situações muito mais comuns, como a esteatose ligada ao consumo exagerado de álcool ou de frutose, presente em refrigerantes e outros produtos adoçados. A hipótese é que qualquer condição que provoque acúmulo de G3P no fígado possa acionar o mesmo circuito metabólico, levando tanto à deposição de gordura quanto à alteração do apetite por açúcar. Em suma, entender esse eixo metabólico permite conectar alimentação, hormônios e comportamento de forma integrada.
Os dados vêm de uma combinação de análises em humanos e em modelos experimentais, principalmente camundongos com alterações semelhantes às observadas na doença humana. Nesses animais, pesquisadores observaram com clareza a sequência de eventos: aumento de G3P, ativação de ChREBP, elevação do FGF21 e acúmulo de gordura no fígado, mesmo sem ganho de peso significativo. Isso reforça a ideia de que, em alguns casos, a qualidade do metabolismo hepático importa tanto quanto a quantidade de calorias ingeridas. Portanto, intervenções futuras podem priorizar não apenas “comer menos”, mas “metabolizar melhor”.
No campo da pesquisa biomédica, esses achados abrem espaço para o desenvolvimento de terapias que atuem diretamente na via G3P–ChREBP–FGF21. Entre os objetivos discutidos estão:
- Reduzir o acúmulo de gordura no fígado, agindo sobre pontos específicos da cadeia metabólica;
- Modificar, de maneira controlada, a sinalização hormonal ligada ao desejo por açúcar e álcool;
- Identificar marcadores sanguíneos que indiquem precocemente o desequilíbrio no metabolismo hepático.
De forma geral, o estudo da deficiência de citrina mostra como um distúrbio raro pode lançar luz sobre problemas muito frequentes na população, como a MASLD e outras formas de esteatose. Ao compreender melhor a comunicação entre fígado, hormônios e cérebro, torna-se possível pensar em estratégias mais precisas para prevenir e tratar a gordura no fígado, levando em conta não apenas o peso corporal, mas também o modo como o organismo lida com carboidratos e gorduras no dia a dia. Em suma, conhecer essas vias metabólicas abre caminho para medicina mais personalizada e preventiva.
FAQ – Perguntas frequentes sobre deficiência de citrina, MASLD e metabolismo hepático
1. A deficiência de citrina tem cura?
Não existe cura definitiva, porém o acompanhamento com hepatologista e nutricionista, aliado a ajustes alimentares (como controle rigoroso de carboidratos simples e preferência por proteínas e gorduras de boa qualidade), pode melhorar sintomas e frear a progressão da doença hepática.
2. Que exames podem sugerir deficiência de citrina ou problemas nessa via metabólica?
Exames de sangue com alteração de enzimas hepáticas (TGO, TGP, GGT), dosagem de triglicerídeos, glicemia e, em centros especializados, avaliação de FGF21 e estudos genéticos do gene SLC25A13 podem auxiliar. Entretanto, o diagnóstico final exige avaliação médica detalhada.
3. Ser magro(a) garante proteção contra gordura no fígado?
Não. Pessoas magras podem ter MASLD e outras formas de esteatose, principalmente quando apresentam dieta rica em frutose, sedentarismo, sono irregular ou predisposição genética. Portanto, exames de rotina e estilo de vida saudável continuam fundamentais.
4. Como a alimentação pode ajudar quem tem tendência à gordura no fígado?
Reduzir bebidas adoçadas, refrigerantes, doces concentrados e ultraprocessados é essencial. Então, priorizar alimentos in natura, como frutas inteiras (em quantidades adequadas), verduras, legumes, proteínas magras e gorduras boas (azeite, oleaginosas, peixe) favorece o metabolismo hepático.
5. O FGF21 pode virar um remédio no futuro?
Diversos estudos já testam análogos de FGF21 ou medicamentos que modulam essa via. Entretanto, ainda são necessários mais dados de segurança e eficácia em longo prazo. Portanto, por enquanto, o uso permanece restrito à pesquisa clínica.
6. Atividade física influencia a via G3P–ChREBP–FGF21?
Sim. Exercícios aeróbicos e de força melhoram a sensibilidade à insulina, reduzem triglicerídeos e ajudam o fígado a lidar melhor com carboidratos e gorduras. Em suma, um programa regular de atividade física pode atenuar o impacto negativo dessa via sobre o acúmulo de gordura hepática.