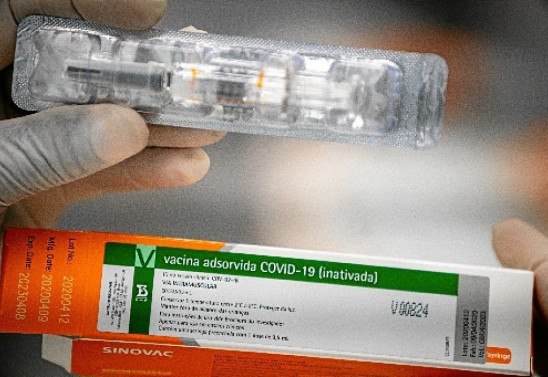
O Instituto Butantan, responsável pela vacina chinesa Coronavac no Brasil, teme que a guerra política travada em torno de um imunizante contra a covid-19 crie interferência deliberadas para o início das produções. A instituição enviou um pedido formal à Agência Nacional de Vigilância Sanitária (Anvisa) para que os insumos fossem importados em caráter acelerado, possibilitando a produção do imunizante no Brasil, a fim de cumprir o calendário anunciado de fabricar, até o fim do ano, 40 milhões de doses. No entanto, o instituto foi informado, nesta quinta-feira (22/10), que a análise seria feita somente em 11 de novembro.
"O Instituto Butantan aguarda, desde 18 de setembro, parecer da Anvisa ao pedido de importação de matéria-prima para produção da Coronavac no Brasil. A agência só deve deliberar sobre o tema daqui a três semanas, impactando as perspectivas de produção e disponibilização de vacina contra a covid-19 para a população brasileir", informou a instituição.
A demora para tratar sobre assunto tinha como justificativa o período de transição da composição da diretoria colegiada. No entanto, o Butantan retrucou com um pedido de reconsideração. "O pedido do Butantan tem caráter excepcional para agilizar o fornecimento do imunizante no Brasil, contribuindo para salvar vidas e combater a pandemia. Obviamente, a vacina não será aplicada sem aprovação e registro da Anvisa, que serão requeridos ao fim dos estudos clínicos de segurança e eficácia da vacina", esclareceu.
Diante da repercussão, a agência decidiu protocolar o pedido no circuito deliberativo, uma forma de votação que não depende do encontro presencial para deliberação. "Este tipo de votação deve apresentar decisão em no máximo 5 dias úteis", informou a Anvisa.
"Ainda que o pedido de importação seja autorizado, a vacina não pode ser aplicada na população, tendo em vista que a Coronavac não possui registro sanitário no Brasil", reforçou a agência. O processo para registro já foi iniciado, com envio de documentos a partir do protocolo facilitado em razão da urgência. Cabe a análise e parecer da Anvisa após a conclusão da fase de envio.
Em entrevista coletiva da última quarta-feira (21), o diretor-presidente da Agência de Vigilância Sanitária (Anvisa), almirante Antônio Barra Torres, deixou claro que não vai rejeitar o pedido de registro de uma vacina só porque o imunizante não teve o apoio do Executivo. “Para nós, pouco importa de onde vem a vacina ou qual é o seu país de origem. Nosso dever constitucional é fornecer as respostas de se esses produtos têm ou não têm qualidade, segurança e eficácia”.
O Instituto Butantan, responsável pela vacina chinesa Coronavac no Brasil, teme que a guerra política travada em torno de um imunizante contra a covid-19 crie interferência deliberadas para o início das produções.