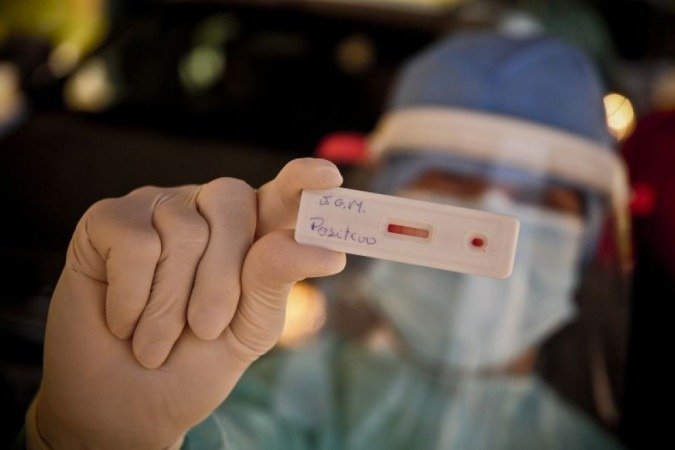
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a extensão por mais quatro meses na validade de 6,8 milhões de testes para detecção da covid-19 que estavam próximos da data de vencimento. Agora, o prazo de validade dos produtos estocados pelo Ministério da Saúde passará a ser de 12 meses, a partir da data de fabricação. A informação foi divulgada pela Anvisa nesta quarta-feira (9/12).
A extensão dos prazos de validade foi solicitada pelo MS e a decisão foi aprovada pela Diretoria Colegiada da Anvisa. A decisão aumenta a validade de produtos para diagnóstico in vitro para detecção do Sars-Cov-2. Os testes foram adquiridos por meio da Organização Pan-Americana da Saúde (Opas).
“A autorização está condicionada à realização de análises periódicas (mensais) de monitoramento para avaliação da especificidade e sensibilidade de todos os lotes dos produtos pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS), devendo o Ministério da Saúde fornecer mensalmente as amostras dos lotes àquele instituto, bem como os insumos necessários para a realização das análises”, informou a Anvisa.
Plano de gerenciamento de risco
Segundo publicação da agência de vigilância sanitária, o Ministério da Saúde deve elaborar um plano de gerenciamento de risco de modo que seja comunicada a autorização da prorrogação na validade dos testes a todos os entes que atuam na distribuição dos produtos. Além disso, o plano também deve buscar fazer a rastreabilidade dos lotes dos produtos e gerar medidas a serem adotadas caso haja quaisquer indicativos de falhas nos testes.
Também foi determinado que o Ministério da Saúde adote medidas adicionais necessárias para fins da manutenção do perfil de qualidade e desempenho dos produtos.
A Anvisa declarou, ainda, que a decisão foi motivada com base nas condições epidemiológicas e sanitárias atuais, “uma vez que se observa o recrudescimento do número de casos da doença; a relação risco/benefício da medida proposta, diante do risco inerente a tais produtos; e as ações que devem ser adotadas para o controle da pandemia, sendo a realização de testes uma delas.”
*Estagiária sob a supervisão de Andreia Castro
Saiba Mais
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Brasil
Brasil
 Brasil
Brasil