A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou nesta segunda-feira (14/12) que terá o prazo de até 10 dias para aprovar ou não o pedido do uso emergencial de uma vacina contra a covid-19. Até o momento, nenhuma empresa desenvolvedora de imunizante contra o novo coronavírus solicitou pedido de uso emergencial.
“Se todo os documentos necessários forem submetidos à Anvisa pelos fabricantes da vacina, a Anvisa estima que o prazo de até 10 dias para concluir a avaliação quanto à autorização de uso emergencial, desde que sejam vacinas das empresas que venham apresentando dados para Anvisa e possuam ensaios clínicos em condução no Brasil”, informou por meio de nota.
Na última quinta-feira (10), a diretoria da Anvisa oficializou a possibilidade do uso emergencial de uma vacina contra a covid-19. Os diretores da Anvisa acompanharam, por unanimidade, o voto da relatora do processo que trata do assunto, Alessandra Bastos Soares.
Somente empresas com imunizantes que participam de ensaios clínicos na fase 3 no Brasil conseguirão entrar com o pedido.
Sem pausa no Natal e Ano Novo
Por meio de nota, a agência declarou que continuará trabalhando em tempo integral neste fim de ano para decidir e avaliar o pedido de autorização de uso emergencial. “A Anvisa continuará trabalhando, inclusive no período de Natal e Ano Novo, para favorecer o acesso seguro, eficaz e de qualidade das vacinas covid-19, desde que alguma empresa competente solicite a esta agência”, completou.
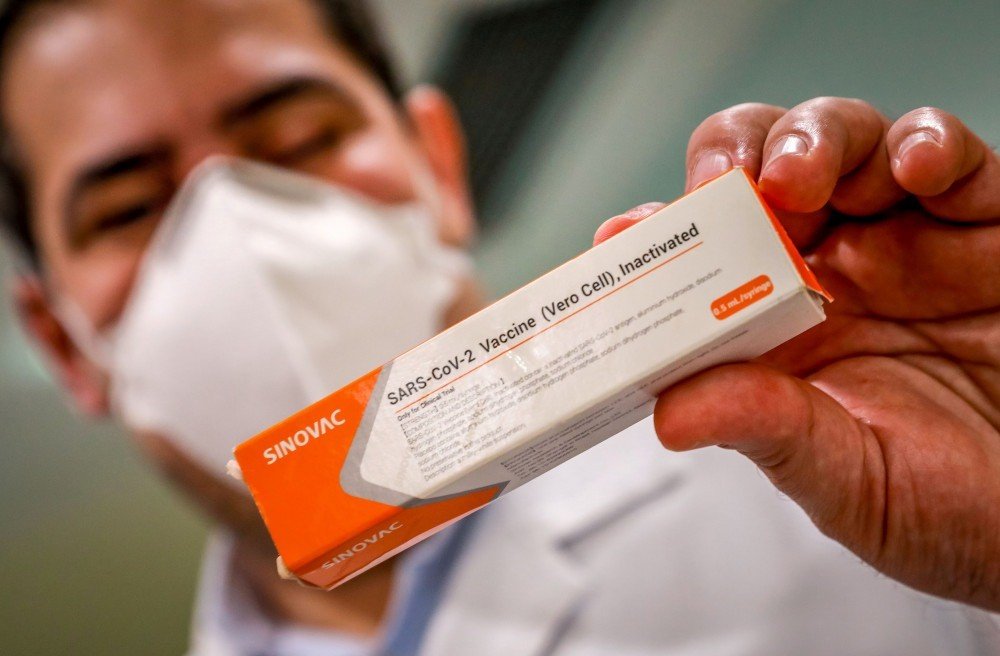
Mais cedo, durante coletiva de imprensa do governo de São Paulo, o diretor do Instituto Butantan, Dimas Covas, foi questionado se estaria preocupado com um possível atraso na aprovação do registro da vacina CoronaVac, por causa dos feriados de final de ano, já que o envio dos resultados dos testes foi adiado para 23 de dezembro.
“Cumprimos a nossa parte e esperamos que as agência reguladoras do Brasil e da China também cumpram a sua obrigação de registrar esse produto o mais rapidamente possível visto que estamos no meio da pandemia”, respondeu Covas.
Saiba Mais
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Brasil
Brasil
 Brasil
Brasil