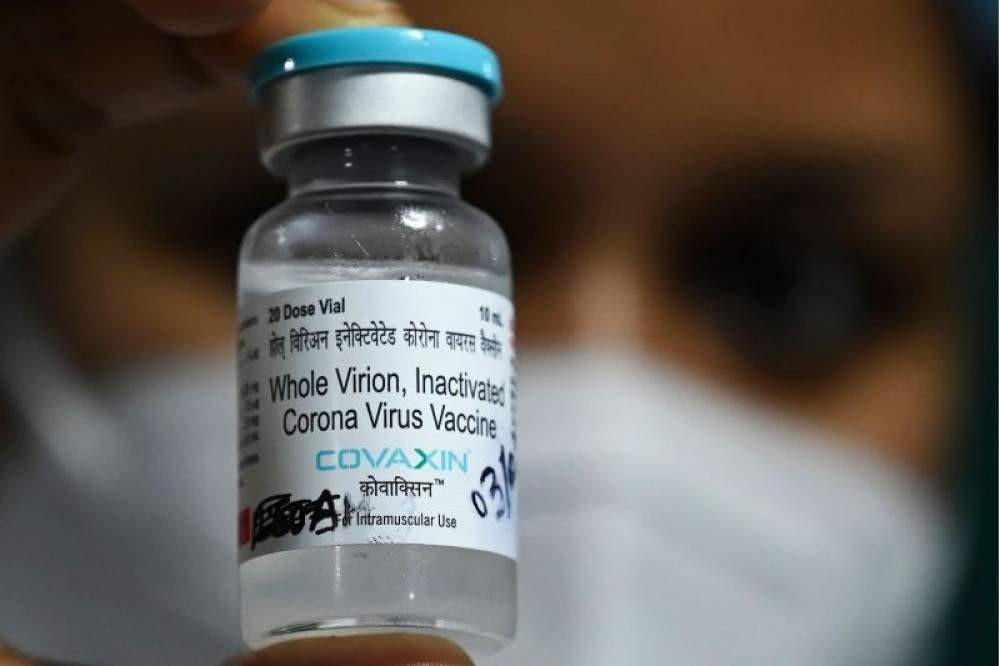
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta quinta-feira (13/5) o estudo clínico da vacina contra covid-19 Covaxin. O imunizante indiano é fabricado pelo laboratório Bharat Biothec International Limited e será testado em 4,5 mil brasileiros com mais de 18 anos.
Os testes devem ser realizados em quatro estados brasileiros: São Paulo, Rio de Janeiro, Bahia e Mato Grosso. No entanto, o início do estudo ainda depende da aprovação da Comissão Nacional de Ética em Pesquisa (Conep), órgão responsável pela avaliação ética de pesquisas clínicas, e também da organização interna dos pesquisadores para recrutamento dos voluntários.
No Brasil, os testes serão feitos com a aplicação de duas doses do imunizante, com 28 dias de intervalo entre elas. Além de ser testada no Brasil, a Covaxin já participa de um estudo na Índia com outros 26,3 mil voluntários.
O estudo clínico aprovado pela Anvisa é de fase 3. Nele, a vacina é administrada a uma grande quantidade de indivíduos para que seja demonstrada a eficácia e segurança do fármaco. “Os ensaios clínicos são os estudos de um novo medicamento realizados em seres humanos. A fase clínica serve para validar a relação de eficácia e segurança do medicamento e para validar novas indicações terapêuticas”, explicou a agência em nota.
Antes de autorizar os testes em voluntários brasileiros, a agência reguladora do país analisou os dados de etapas anteriores, como estudos em animais. “Os resultados obtidos até o momento demonstraram um perfil de segurança aceitável das vacinas candidatas”, concluiu a Anvisa.
Comprada pelo governo
Mesmo sem aprovação da Anvisa para uso da vacina, seja por meio de autorização de uso emergencial, de registro definitivo ou de autorização de importação, o governo federal já fechou um contrato de R$ 1,614 bilhão para a compra de 20 milhões de doses da Covaxin.
A previsão apontada inicialmente pelo Ministério da Saúde era receber as primeiras unidades ainda em março, mas no mesmo mês a Anvisa negou a a autorização excepcional e temporária para importação e distribuição da vacina Covaxin.
A decisão foi garantida por unanimidade já que os cinco diretores que compõem a Diretoria Colegiada da agência votaram contra a importação do imunizante. Na época, os diretores apontaram inconsistência na documentação, com lacunas importantes para garantir que a eficácia, segurança e qualidade da vacina possam ser cumpridas.
Saiba Mais
-
![]() Brasil
Doses de vacina contra covid-19 serão 46% a menos do que esperado para abril
Brasil
Doses de vacina contra covid-19 serão 46% a menos do que esperado para abril
-
![]() Brasil
Queiroga: grupos prioritários serão vacinados até setembro
Brasil
Queiroga: grupos prioritários serão vacinados até setembro
-
![]() Brasil
Covid-19: Ministério da Saúde apresenta cronograma com menos doses de vacinas
Brasil
Covid-19: Ministério da Saúde apresenta cronograma com menos doses de vacinas
-
![]() Brasil
Governo confirma que comprou só metade das 560 milhões de doses anunciadas
Brasil
Governo confirma que comprou só metade das 560 milhões de doses anunciadas
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil