


A aprovação da primeira vacina contra a covid-19 para crianças de 5 a 11 anos no Brasil levantou uma série de dúvidas em pais e tutores. Será que a aplicação desse produto pode trazer algum perigo à saúde nessa faixa etária?
Segundo entidades nacionais e internacionais e as evidências científicas disponíveis até o momento, os benefícios de vacinar o público infantil superam, de longe, os potenciais riscos.
- Covid: liberação de vacina da Pfizer para crianças é excelente notícia e traz 'horizonte melhor para 2022', avaliam especialistas
- 6 perguntas sobre a vacinação em crianças, autorizada pela Anvisa no Brasil
Essa é a conclusão não apenas da Agência Nacional de Vigilância Sanitária (Anvisa), que liberou a vacina da Pfizer para crianças brasileiras, mas de instituições como o Centro de Controle e Prevenção de Doenças (CDC) dos Estados Unidos e a Organização Mundial da Saúde.
Até o momento, de acordo com os registros de vários países, o principal evento adverso observado é a dor no braço, mais especificamente no local da injeção. Esse incômodo costuma melhorar naturalmente com o passar de alguns dias.
Outros efeitos transitórios que podem aparecer são vermelhidão e inchaço no braço, cansaço, dor de cabeça, dores musculares e calafrios.
Até o momento, não foram observados casos de miocardite (um tipo de inflamação cardíaca) pós-vacinação em crianças de 5 a 11 anos.
Entenda a seguir como os cientistas determinam a segurança de uma vacina e o que se sabe especificamente sobre a probabilidade de eventos adversos relacionados ao imunizante da Pfizer nas crianças.
Etapa 1: os testes clínicos
As pesquisas são fundamentais para determinar a dosagem da vacina, se há necessidade de duas ou mais aplicações, qual é o intervalo entre elas, a reação do sistema imunológico e os possíveis efeitos colaterais.
Geralmente, esses estudos são feitos em três etapas diferentes. Conforme a investigação avança, o número de voluntários aumenta e chega a incluir até milhares de pessoas na última fase.
Para observar se a vacina da Pfizer teria capacidade de proteger as crianças, os cientistas fizeram dois estudos diferentes.
O primeiro deles tinha como objetivo determinar a dose ideal do imunizante para o público infantil.
Para isso, foram testadas três dosagens do produto (de 10, 20 e 30 microgramas) em 48 participantes.
Os resultados mostraram que a versão de 10 microgramas foi segura (ou seja, não provocou nenhuma reação adversa digna de nota) e bem tolerada.
A próxima etapa do estudo envolveu mais de 2.250 voluntários, recrutados por 90 centros de pesquisa espalhados por Estados Unidos, Finlândia, Espanha e Polônia.
Cerca de 1,5 mil deles receberam duas doses de vacina da Pfizer, com um intervalo de 21 dias entre elas. Os 750 restantes tomaram placebo, uma substância sem efeitos no organismo.

Os resultados, publicados no periódico especializado The New England Journal of Medicine, mostram que não houve diferenças de efeitos colaterais entre os dois grupos (quem tomou vacina de verdade ou quem tomou placebo).
No experimento, ao redor de 10% dos participantes tiveram alguma queixa pós-vacinação: os eventos adversos observados foram de leves a moderados e passaram após algum tempo.
O principal incômodo foi mesmo a dor no local da aplicação, seguido de dor de cabeça, fadiga e calafrios.
Etapa 2: análise independente e aprovação
Com todos esses dados em mãos, a farmacêutica entrou com o pedido de autorização para uso da vacina em larga escala no público infantil.
Requisições do tipo são analisadas pelas agências regulatórias, como a Anvisa do Brasil, a EMA da Europa e a FDA dos Estados Unidos.
Essas instituições possuem profissionais especializados em analisar e revisar todas essas informações técnicas, para conferir se elas são confiáveis ou não.
A meta desses funcionários é estabelecer, com base nos dados disponíveis, se determinado produto é seguro e eficaz, e se o seu uso em larga escala na população vai trazer mais benefícios do que riscos.
Caso a resposta para essas perguntas seja positiva, o pedido será aceito e a formulação fica liberada num país ou numa região.
Foi justamente todo esse processo pelo qual passou a vacina da Pfizer, recém-aprovada para crianças pela Anvisa, com o endosso de diversas entidades médicas, como as sociedades brasileiras de pediatria, de imunizações, de infectologia, de imunologia, de saúde coletiva e de pneumologia e tisiologia.
"Na comparação entre os dois grupos [do estudo clínico], o perfil de segurança é muito positivo e não houve diferenças importantes entre quem recebeu vacina ou placebo. Não foram observados relatos de eventos adversos sérios, de maior preocupação", ratificou Gustavo Mendes, gerente-geral de Medicamentos e Produtos Biológicos da Anvisa, um dos responsáveis por fazer esse tipo de análise no Brasil.
Etapa 3: vigilância e experiência de vida real
Mas é claro que a preocupação com a segurança não termina com os testes clínicos: após a aprovação, tem início a fase de vigilância e notificação de eventos adversos.
Essa etapa é importantíssima para identificar possíveis efeitos colaterais que não foram observados nos estudos científicos.
Afinal, durante as pesquisas, o produto é avaliado em alguns milhares de indivíduos. Após a liberação, no entanto, ele é aplicado numa escala bem maior, em milhões de pessoas, algumas delas com características ou particularidades que eventualmente não estavam contempladas nos grupos de voluntários.
Pode ser, então, que apareça alguma complicação inesperada.
Nessa situação atípica, o caso precisa ser notificado para a agência regulatória (a Anvisa, no caso do Brasil), que abre uma investigação para apurar os fatos e conferir se o evento adverso teve a ver (ou não) com a vacina.
Caso se comprove que o imunizante está por trás de um problema desconhecido até então, seu uso pode ser suspenso de forma temporária ou definitiva.
E esse trabalho de vigilância, inclusive, já está em andamento nos países que estão vacinando as crianças contra a covid-19, como Estados Unidos, Reino Unido, Alemanha, França, Espanha e Coreia do Sul.
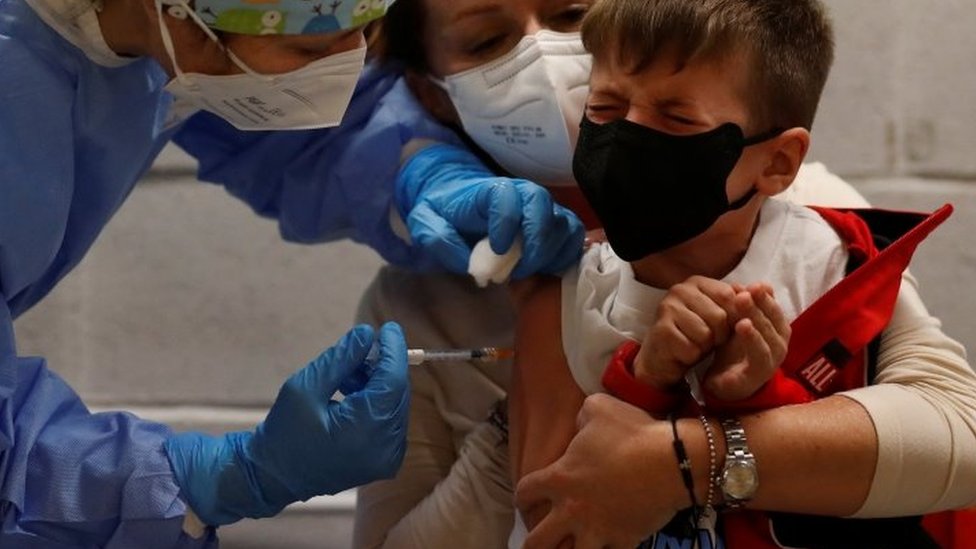
Durante uma apresentação no dia 16 de dezembro, a gerente-geral de Monitoramento da Anvisa, Suzie Marie Gomes, fez um resumo do que observou até agora em relação à segurança "de mundo real" do imunizante da Pfizer no público infantil.
De acordo com os bancos de dados oficiais, que em sua maioria vêm dos Estados Unidos, até o meio de dezembro cerca de 5 milhões de crianças haviam sido vacinadas.
Dessas, 2.942 (ou 0,05% do total) apresentaram alguma reação adversa.
E, mesmo entre as que tiveram algum efeito indesejado pós-vacinação, em 94,9% das vezes o problema foi considerado "não grave".
Gomes ainda destacou que boa parte dos eventos adversos observados na prática até agora tem a ver com falhas preveníveis, como a administração do produto de forma ou na dosagem inadequada.
É justamente para evitar que erros parecidos possam ocorrer por aqui que a Anvisa promete fazer uma série de treinamentos com os profissionais que atuam nas salas de vacinação, além de lançar campanhas de comunicação.
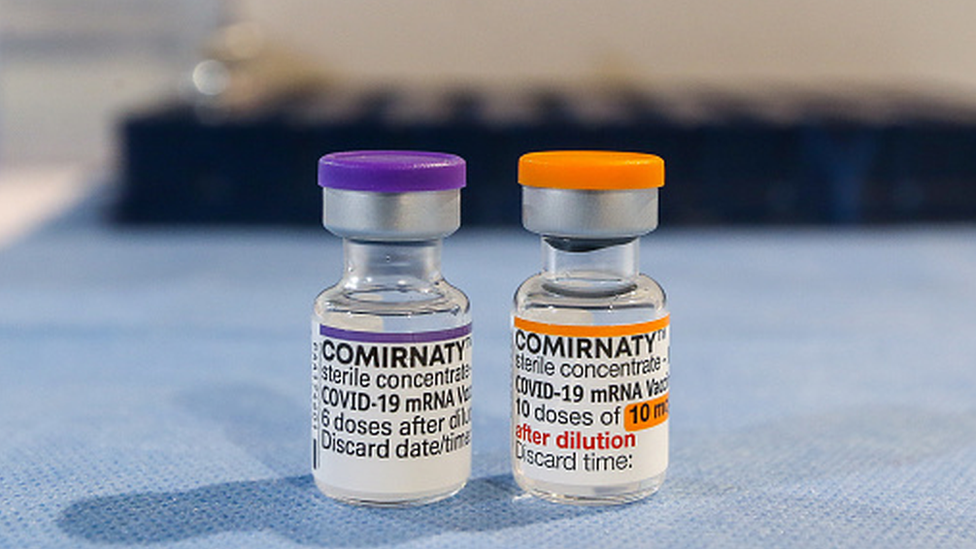
Outra estratégia adotada no Brasil e no exterior é a de diferenciar as vacinas da Pfizer para crianças e adultos: as doses para quem tiver entre 5 a 11 anos virão num frasco laranja, enquanto aquelas destinadas a maiores de 12 anos terão uma embalagem roxa. A meta é evitar a aplicação de um produto inadequado nos mais jovens.
Mas e a miocardite?
Um ponto que levanta muita preocupação em pais e tutores desde que se começou a discutir a vacinação dos mais jovens é o risco de desenvolver miocardite ou pericardite, tipos de inflamação que acometem o coração.
Esse evento adverso foi observado em alguns poucos indivíduos que receberam vacinas de mRNA, como aquelas produzidas por Pfizer e Moderna.
Embora não se conheça muito bem os mecanismos por trás dessa complicação, esse problema apareceu com mais frequência em adolescentes do sexo masculino de 16 e 17 anos.
Mesmo assim, os casos de inflamação cardíaca pós-vacinação são considerados bem raros pelas autoridades.
De acordo com o CDC dos Estados Unidos, cerca de 0,007% dos adolescentes do sexo masculino imunizados desenvolveram essa complicação até o momento.
A maioria deles, de acordo com a entidade, se recuperou e estava bem após algum tempo.
Já um trabalho feito em Israel observou 54 casos de miocardite em 2,5 milhões de pessoas de 16 anos ou mais vacinadas.
Desses, 76% dos quadros foram considerados leves e 22% moderados.
Até o momento, não foram observados casos de miocardite pós-vacinação em crianças de 5 a 11 anos.
E vale lembrar aqui que a própria infecção pelo coronavírus também tem a inflamação cardíaca como uma de suas possíveis complicações.
Uma análise feita recentemente por especialistas da Universidade de Oxford, no Reino Unido, mostrou que há um risco quatro vezes maior de desenvolver miocardite após a covid-19 do que depois de ser vacinado contra essa mesma doença.
Os benefícios superam os riscos?
Por fim, pode-se pensar que, pelo fato de a covid ser teoricamente mais branda no público infantil, a vacinação nessa idade seja menos importante ou urgente.
As instituições de saúde nacionais e internacionais não concordam com esse argumento: segundos dados do Ministério da Saúde, mais de 2,5 mil crianças brasileiras morreram de Síndrome Respiratória Aguda Grave (SRAG) desde o início da pandemia, sendo o coronavírus o principal suspeito de estar por trás da maioria desses óbitos.
Como destacaram os representantes das sociedades médicas durante a reunião com a Anvisa no dia 16/12, esse número supera o total de mortes por todas as outras doenças infecciosas para as quais temos vacinas disponíveis no sistema público.
Além disso, pensar que a "imunidade natural" após ter covid pode trazer o mesmo efeito das doses de vacina para o público infantil representa um perigo dos grandes.
"Ninguém deve tentar expor a si mesmo ou outras pessoas a covid-19 de propósito. O risco de infecção nas crianças é semelhante ao de adultos. Quando elas estão com a doença, podem ficar doentes por vários dias, além de faltar às aulas e outras oportunidades de aprender e brincar", responde o CDC americano.
"Crianças que não foram vacinadas e pegam covid também correm o risco de ficar hospitalizadas, ter síndrome inflamatória multissistêmica, desenvolver complicações de longo prazo [a covid longa] e até morrer", segue a entidade, num texto publicado em seu site.
"Vacinar as crianças contra a covid pode ajudar a protegê-las, mantê-las na escola e em atividades sociais e ainda auxilia a impedir a disseminação do coronavírus na comunidade", finaliza o CDC.
Sabia que a BBC está também no Telegram? Inscreva-se no canal.
Já assistiu aos nossos novos vídeos no YouTube? Inscreva-se no nosso canal!
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
