
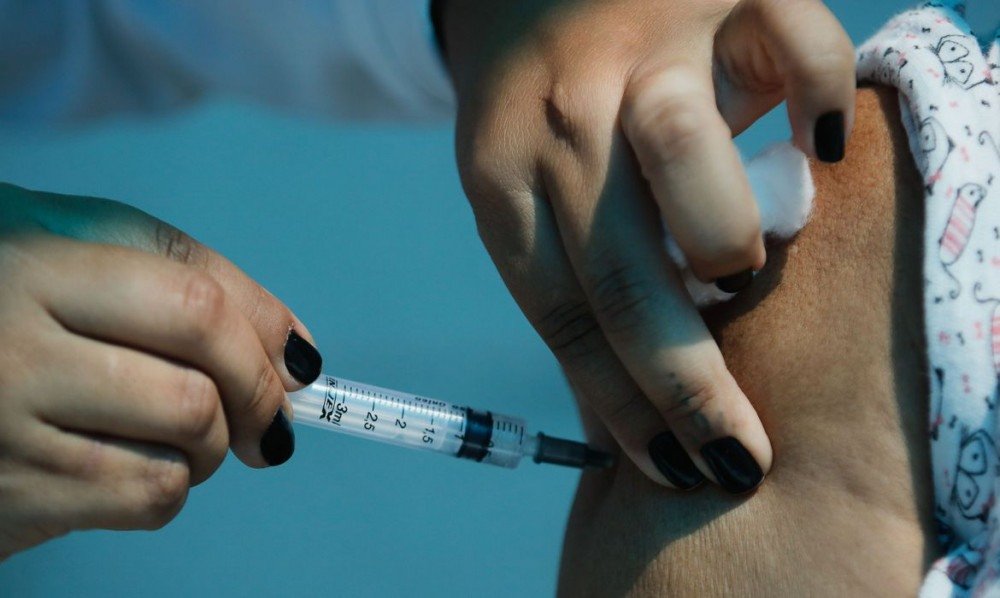
Num momento em que o Brasil caminha para o colapso, devido ao descontrole na disseminação do novo coronavírus, a Agência Nacional de Vigilância Sanitária (Anvisa) decidiu agir para enfrentar esse quadro dramático. O órgão anunciou, ao mesmo tempo, o registro definitivo da vacina da Oxford e da AstraZeneca, contra a covid 19, produzida pela Fundação Oswaldo Cruz (Fiocruz), e o uso do antiviral Remdesivir, que foi usado no tratamento ao ebola e está em fase de teste em relação à covid-19. É o primeiro medicamento autorizado no Brasil com este fim. “Estamos enfrentando um momento muito complicado”, admitiu o gerente-geral de Medicamentos da Anvisa, Gustavo Mendes.
Com o registro definitivo da vacina da Oxford e da AstraZeneca, será permitida a entrega do imunizante produzido no país. Até então, a Anvisa já havia autorizado o uso emergencial da mesma vacina importada da Índia e fabricada pelo Instituto Serum. A agência reguladora ressaltou, no entanto, que o registro não permite a venda ao setor privado, uma vez que a Fiocruz só tem como clientes o Sistema Único de Saúde (SUS) e os organismos multilaterais.
Quanto ao Remdesivir, a Anvisa destacou que testes apontaram que a substância impede a replicação do vírus no organismo, diminuindo o processo de infecção. O registro foi concedido para o laboratório Gilead. É importante ressaltar que o antiviral já havia sido autorizado pela agência sanitária dos Estados Unidos em 2020 e utilizado pelo ex-presidente Donald Trump, após ser diagnosticado com covid-19. O Remdesivir é injetável e será produzido pela empresa no formato de pó para diluição. Durante os estudos clínicos do produto no Brasil, não foram registrados eventos adversos graves com os voluntários.
Produção local
Agora, com o registro definitivo da vacina da Oxford, a Fundação Oswaldo Cruz espera entregar aproximadamente 222 milhões de doses ainda neste ano, das quais 112 milhões até julho. A partir do segundo semestre, a Fiocruz promete que o imunizante será produzido totalmente no Brasil, desde sua primeira fase, sem a necessidade de importação do insumo farmacêutico ativo (IFA) de fábrica da China. Se tudo der certo, a fundação distribuirá 3,8 milhões de doses ainda neste mês.
Os testes mostraram que a vacina da Oxford e da AstraZeneca tem eficácia global de 70,42%. A validade é de seis meses, mas pode ser ampliada, de acordo com conforme análises mensais. Segundo a Anvisa, ainda há incertezas sobre o produto, mas que os benefícios superam os riscos de se conceder o registro. Será preciso, no entanto, confirmar dados como dos resultados em idosos, para prevenir formas graves da doença e para neutralizar novas variantes do coronavírus. Não à toa, a agência condicionou o registro à apresentação de uma série de dados pela Fiocruz.
O registro definitivo desta vacina e a autorização do antiviral Remdesivir vêm num momento em que o Brasil está batendo recordes diários de mortes. Nos últimos dois dias, foram mais de 4,5 mil. Na maioria dos estados, as UTIs estão com mais de 90% de ocupação, ou seja, perto de colapsarem. Mesmo com uma série de medidas restritivas adotadas por prefeitos e governadores, a covid-19 não dá trégua. Em São Paulo, há pessoas morrendo da fila de espera, sem atendimento, por falta de leitos e de pessoal.
Outras vacinas
Conforme Gustavo Mendes, a Anvisa está trabalhando duro para liberar outras vacinas. No caso da Pfizer, já foi dado o registro definitivo e há uma negociação do Ministério da Saúde para comprar o imunizante. Ele ressaltou que a Janssen, da Johnson & Johnson, tem reunião marcada com a agência em 16 de março para tratar sobre pedido de uso emergencial ou registro definitivo de sua vacina, com estudos finais conduzidos no Brasil.
No caso da vacina da Moderna, segundo o técnico da Anvisa, não deve haver barreiras para a entrada no país, uma vez que já foi autorizada por outras agências de peso, como as do Canadá, do Reino Unido e dos Estados Unidos. O Ministério da Saúde negocia a compra de 63 milhões de doses do imunizante, sendo que 13 milhões poderiam ser entregues neste ano.
A Anvisa também aguarda informações da russa Sputnik V e da indiana Covaxin, respectivamente, e que o Ministério da Saúde já autorizou a compra. A agência recebeu ainda dados sobre imunizantes que estão em desenvolvimento, como os do Institute of Medical Biology, Chinese Academy of Medical Sciences; rede Dasa e laboratório Covaxx; Clover Biopharmaceuticals e CanSino. Nestes casos, a agência ainda aguarda dados para avançar em estudos clínicos ou pedidos de uso dos produtos.
Sobre estudos desenvolvidos no Brasil, Mendes listou os conduzidos pela Faculdade de Medicina da USP em Ribeirão Preto, e as universidades federais e Minas Gerais (UFMG) e do Rio de Janeiro (UFRJ), todos em fases iniciais, mas que estão recebendo suporte científico da Anvisa.
Confira o anúncio:
Saiba Mais
-
![]() Brasil
Bolsonaro contradiz fatos e diz que nunca se referiu à covid-19 como 'gripezinha'
Brasil
Bolsonaro contradiz fatos e diz que nunca se referiu à covid-19 como 'gripezinha'
-
![]() Política
Bolsonaro ataca 'lockdowns' dos Estados e diz ver 'problemas sérios' pela frente
Política
Bolsonaro ataca 'lockdowns' dos Estados e diz ver 'problemas sérios' pela frente
-
![]() Mundo
Covid: Altimmune anuncia nos EUA parceria da Lonza na produção de eventual vacina
Mundo
Covid: Altimmune anuncia nos EUA parceria da Lonza na produção de eventual vacina
-
![]() Brasil
Anvisa aprova registro definitivo de vacina de Oxford produzida na Fiocruz
Brasil
Anvisa aprova registro definitivo de vacina de Oxford produzida na Fiocruz
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Brasil
Brasil
 Política
Política
 Mundo
Mundo
 Brasil
Brasil