
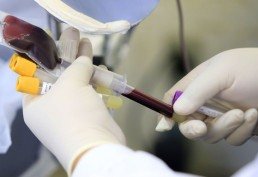
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, nesta quarta-feira (23/2), o primeiro registro sanitário de um produto de terapia gênica, que utiliza células T, para o combate ao câncer hematológico. Já aprovado também por outras agências reguladoras do mundo, os benefícios do uso do produto Kymriah (tisagenlecleucel), da empresa Novartis Biociências S.A, foram considerados superiores aos seus riscos pelo órgão.
Classificado como um produto de terapia avançada, o Kymriah faz parte de uma nova geração de imunoterapias personalizadas contra o câncer, que realizam a modificação genética de células imunes dos próprios pacientes.
A Anvisa explicou que "as células T do paciente são coletadas no serviço de saúde e enviadas para um centro de fabricação, onde são geneticamente modificadas". Na mudança, feita nos Estados Unidos, são incluídos novos genes que contêm uma proteína específica que direciona as células T para matar células do câncer.
"Depois de modificadas no laboratório, as células são cultivadas e formuladas em suspensão farmacêutica para compor o produto que será inoculado no paciente", esclareceu a agência em nota.
Esta é a primeira vez que a Anvisa registra um produto de terapia avançada, que envolve o uso de material de partida do próprio paciente, as células T, para o tratamento do câncer. O Brasil já possui outros dois produtos de terapia avançada aprovados pela Anvisa. Estes são destinados para o tratamento de atrofia muscular espinhal e distrofias retinianas.
Indicação
O produto é indicado para o tratamento de pacientes pediátricos e adultos jovens (até 25 anos de idade) com Leucemia Linfoblástica Aguda (LLA) de células B, ou pacientes adultos com Linfoma Difuso de Grandes Celulas B (LDGCB).
Segundo a Anvisa, o produto é uma nova opção de tratamento que atende a necessidade de pacientes com câncer grave. "É uma nova opção onde as alternativas são muito limitadas, com taxas de remissão e sobrevivência promissoras nos ensaios clínicos avaliados pela Anvisa", indicou. A análise durou 268 dias.
Saiba Mais
-
![]() Opinião
Até 2030 o câncer será a principal causa de morte no mundo
Opinião
Até 2030 o câncer será a principal causa de morte no mundo
-
![]() Ciência e Saúde
Sintomas e tratamento do câncer de próstata: 'Perdi meu pai, não perca o seu'
Ciência e Saúde
Sintomas e tratamento do câncer de próstata: 'Perdi meu pai, não perca o seu'
-
![]() Brasil
Bloco da Solidariedade quer aumentar doações de sangue até o carnaval
Brasil
Bloco da Solidariedade quer aumentar doações de sangue até o carnaval
-
![]() Diversão e Arte
Esposa de Tiago Leifert comemora resultado da primeira quimioterapia de Lua
Diversão e Arte
Esposa de Tiago Leifert comemora resultado da primeira quimioterapia de Lua
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Opinião
Opinião
 Ciência e Saúde
Ciência e Saúde
 Brasil
Brasil
 Diversão e Arte
Diversão e Arte