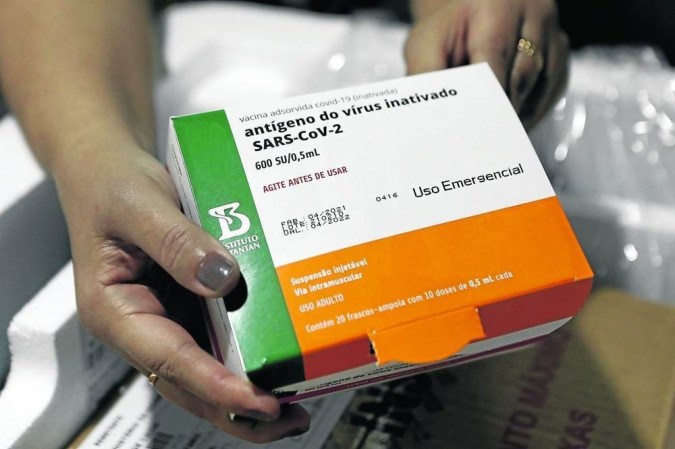
A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou, nesta quarta-feira (13/7), a aplicação emergencial da vacina CoronaVac em crianças de 3 a 5 anos de idade. Durante reunião da diretoria colegiada, em Brasília, por unanimidade, a agência seguiu recomendação das áreas técnicas e autorizou a imunização com duas doses da vacina, em um intervalo de 28 dias. Segundo Alex Machado Campos, segundo diretor a votar, “os dados epidemiológicos não nos deixam outro caminho”.
O imunizante contra a covid-19 é produzido pelo Instituto Butantan. Ainda não há prazo para o início da utilização do imunizante no plano nacional de vacinação, a decisão caberá ao Ministério da Saúde.
A decisão foi baseada em estudos nacionais e internacionais sobre a eficácia da vacina em crianças. As pesquisas foram realizadas pela Fundação Oswaldo Cruz (Fiocruz) e o Butantan, além de entidades internacionais.
A Coronavac está autorizada para uso emergencial no Brasil desde o dia 17 de janeiro de 2021, mas somente em janeiro de 2022 a agência regulatória autorizou a ampliação do uso da vacina para crianças e adolescentes de 6 a 17 anos de idade.
A alteração na bula emergencial da CoronaVac foi um pedido do Instituto Butantan, que, ainda no início de junho, enviou informações para solicitar a ampliação na faixa etária. Uma primeira reunião com a Agência sobre o assunto foi feita em março. Um mês depois, a Anvisa afirmou que os estudos eram insuficientes e solicitou mais dados. Na última sexta-feira (8/7), o Butantan enviou um novo pedido, aprovado na reunião.
Diretora da Anvisa e relatora do processo, Meiruze Sousa Freitas, argumentou em sua fala que a capacidade de uma vacina de proteger da mortalidade e contra doenças graves é o principal parâmetro de relevância para a avaliação da eficácia, pois as internações hospitalares e os cuidados intensivos representam uma grande carga para o sistema de saúde.
“A covid-19 se apresentou como uma crise universal e para algumas crianças, o impacto será para toda vida. Apesar de não serem o rosto da pandemia, elas podem estar entre as maiores vítimas. Sabemos que todas as crianças nos diversos países estão sendo afetadas, mas os efeitos nocivos serão sentidos nos mais vulneráveis, tanto os mais vulneráveis economicamente quanto as com saúde mais debilitada”, afirmou Meiruze.
Gustavo Mendes, gerente-geral de Produtos Biológicos (GGBIO), declarou ser favorável à aprovação do uso emergencial, mas ressaltou a importância da continuidade nos estudos. “Temos uma realidade que o contexto exige ações e estratégias, para que possamos garantir uma cobertura vacinal, mas é preciso acompanhamento dos compromissos e dos dados, para que a gente possa saber por quanto tempo vamos estar protegido, quando vamos precisar de doses de reforço, como é o esquema vacinal para o futuro, como é o desempenho frente às variantes”, disse ele.
Helaine Capucho, gerente-geral de Farmacovigilância (GFARM) propôs a criação de um plano de comunicação de riscos e a inclusão de crianças de 3 a 5 anos no estudo de farmacovigilância ativa, para monitoramento de possíveis eventos adverso. Além disso, a agente de saúde mencionou em seu pronunciamento o estudo publicado na revista científica The Lancet, que estimou que entre 700 e 880 mil vidas foram salvas no Brasil, por conta da vacina contra a covid. De acordo com a publicação, no mundo, esse número é de cerca de 20 milhões.
Marco Aurélio Sáfadi, médico e presidente do Departamento de Infectologia da Sociedade Brasileira de Pediatria, estender a vacinação para esse grupo seria uma estratégia importante para diminuir a carga de hospitalizações e morte. “Os dados hoje disponíveis demonstram um balanço de benefícios em relação a possibilidade de uso da vacina nesse grupo etário e, portanto, entendo que a extensão do uso da vacina traria benefícios a essa população e poderia propiciar uma diminuição do risco de hospitalização e do risco de desfechos graves associados a covid-19”, pontuou.
Um dos estudos clínicos sobre o tema, feito no Chile, mostrou efetividade de 55% da CoronaVac contra a hospitalização de crianças que testam positivo para a covid-19. Além disso, as crianças que participaram dos estudos clínicos apresentaram maior número de anticorpos e menos reações à vacina em relação aos adultos.
No Brasil, as reações graves após a imunização foram consideradas raras e raríssimas, a conclusão foi obtida após análise de 103 milhões de doses aplicadas no país.
*Estagiária sob supervisão de Ronayre Nunes
Saiba Mais
-
![]() Brasil
Presa mulher que matou o marido asfixiado com a ajuda da vizinha
Brasil
Presa mulher que matou o marido asfixiado com a ajuda da vizinha
-
![]() Brasil
Prefeitura vai pedir demolição de prédio que pegou fogo em São Paulo
Brasil
Prefeitura vai pedir demolição de prédio que pegou fogo em São Paulo
-
![]() Brasil
Com recorde de queimadas, governo gasta só 18% do orçamento contra incêndio
Brasil
Com recorde de queimadas, governo gasta só 18% do orçamento contra incêndio
-
![]() Brasil
Covid-19: Anvisa libera CoronaVac para crianças de 3 a 5 anos de idade
Brasil
Covid-19: Anvisa libera CoronaVac para crianças de 3 a 5 anos de idade
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil