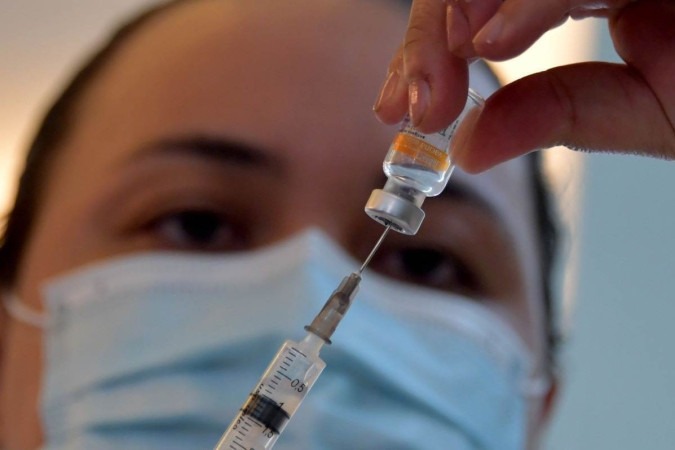
Diante polêmica criada sobre a aprovação da vacina da Pfizer para crianças de 5 a 11 anos, a Agência Nacional de Vigilância Sanitária (Anvisa) divulgou nesta quarta-feira (22/12) os pareceres públicos completos da autorização do imunizante para o público pediátrico. Ainda hoje, a agência reguladora enviou uma exigência técnica ao Instituto Butantan para pedir mais informações sobre o pedido de autorização do uso da CoronaVac para crianças e adolescentes de 3 a 17 anos. Na terça (21), a Anvisa informou que ainda faltam informações para que a equipe técnica da agência avalie o pedido feito pelo instituto paulista.
"Na prática, a exigência é um apontamento sobre dados ou resultados que precisam ser apresentados pelo laboratório para a análise do pedido de indicação solicitado. O pedido de exigência é comum nos processos de analise de vacinas. Este pedido não interrompe a análise pelos técnicos da Anvisa que continuam trabalhando, porém a exigência suspende a contagem do prazo de 30 dias que a Anvisa tem para avaliar o processo", explicou a Anvisa em nota.
Segundo a agência, o Butantan precisará enviar mais dados, como os de segurança por faixa etária pediátrica. Em agosto, o instituto paulista já teve um pedido para uso da CoronaVac em crianças e adolescentes negado pela Anvisa "por causa da limitação de dados dos estudos apresentados naquele momento".
Enquanto aguarda os novos dados do Butantan, a agência já aprovou uma vacina para o público pediátrico ao autorizar o uso do imunizante da Pfizer em crianças de 5 a 11 anos. Nesta quarta (22), divulgou os pareceres das áreas técnicas que avaliaram o pedido da farmacêutica. A divulgação ocorre no mesmo dia em que o Ministério da Saúde publicou, no Diário Oficial da União (DOU), a abertura da consulta pública que vai avaliar a vacinação de crianças contra a covid-19 com o imunizante da Pfizer.
Foram divulgados o parecer público de avaliação de medicamentos e o parecer técnico do plano de gerenciamento de riscos. "As avaliações pela Anvisa de solicitações de autorização de vacinas são realizadas por equipes multidisciplinares de especialistas em regulação e vigilância sanitária devidamente capacitados para esse fim. Estes servidores são de carreira de Estado, concursados com dedicação exclusiva", informou a Anvisa.
Além disso, a agência informou que levou em consideração o relatório da aprovação da mesma vacina pela agência regulatório dos Estados Unidos (FDA). A decisão da Anvisa foi apoiada por diversas sociedades médicas brasileiras.
Saiba Mais
-
![]() Brasil
Após morte da filha de 8 anos por covid, mãe pede liberação da vacina para crianças
Brasil
Após morte da filha de 8 anos por covid, mãe pede liberação da vacina para crianças
-
![]() Brasil
Anvisa se reúne com médicos para avaliar uso de CoronaVac em crianças
Brasil
Anvisa se reúne com médicos para avaliar uso de CoronaVac em crianças
-
![]() Brasil
Vacinação de crianças é essencial para combater covid-19, dizem especialistas
Brasil
Vacinação de crianças é essencial para combater covid-19, dizem especialistas
-
![]() Brasil
6 perguntas sobre a vacinação em crianças, autorizada pela Anvisa no Brasil
Brasil
6 perguntas sobre a vacinação em crianças, autorizada pela Anvisa no Brasil
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil